6 Les fluides réels
6.1 Les gaz réels
6.1.1 Allure du réseau des isothermes
La loi des gaz parfaits est une loi approchée qui ne représente correctement le comportement des gaz qu’aux faibles pressions.
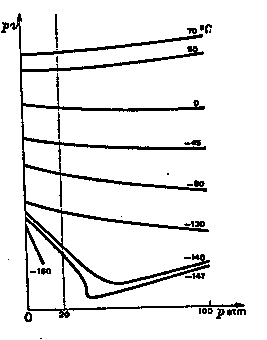
Dans un diagramme d’Amagat
les isothermes d’un gaz parfait sont des droites horizontales.
Les mesures effectuées sur les gaz réels permettent de tracer le réseau des isothermes des gaz réels, par exemple ici l’azote.
Vers les basses températures, les courbes se déforment jusqu’à présenter un point d’inflexion. L’isotherme correspondante est appelée isotherme critique. En dessous de cette température (-147 °C pour l’azote), le gaz peut être liquéfié.
La température pour laquelle la pente de l’isotherme aux basses pressions est nulle est appelée température de Mariotte (50 °C pour l’azote).
6.1.2 Équations d’état
De très nombreuses équations d’état ont été proposées pour rendre compte du comportement réel des fluides. La plus connue, et la plus simple, est l’équation de Van der Waals:
Malheureusement, si cette équation permet d’obtenir un réseau d’isothermes ayant bien l’allure d’un reseau réel, elle ne permet pas d’obtenir des résultats numériques acceptables dans un large domaine de pressions et de températures. Elle a surtout une importance historique car c’est la première à permettre de représenter les deux phases gazeuse et liquide en équilibre. De plus elle est obtenue à partir un raisonnement moléculaire très pertinent. La raison pour laquelle elle est peu précise est qu’elle ne prend pas en compte le détail des forces d’attraction et de répulsion agissant au niveau moléculaire. Aucune équation simple n’est en mesure de donner des résultats précis pour tous les fluides quels que soient la température et la pression.
La plupart des équations d’état utilisées dans l’industrie sont des extensions de l’équation de van der Waals. De plus, toutes les équations d’état ont en commun de tendre vers la loi des gaz parfaits pour les faibles pressions.
Les calculs sont complexes avec la plupart de ces équations d’état et pour s’éviter des calculs fastidieux, notamment en présence de changements d’état, on est amené à utiliser des diagrammes fournissant des solutions graphiques approximatives mais quasi-immédiates. Par ailleurs, le développement de l’informatique permet aujourd’hui d’obtenir des solutions rapides à l’aide de logiciels appropriés.
6.2 Changements d’état
6.2.1 Liquéfaction des gaz
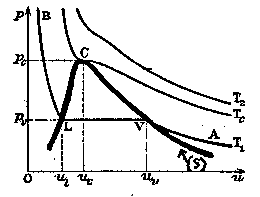
Dans un tube maintenu à température constante, on enferme du CO
puis on fait varier la pression et le volume en poussant sur le piston. Lorsqu’on atteint une certaine pression
, une première goutte de liquide apparaît. Si l’on continue à enfoncer le piston, la masse de liquide produite augmente mais la pression reste constante tandis que le volume occupé par le mélange diminue.
Lorsqu’il n’y a plus que du liquide, la pression augmente très rapidement tandis que le volume diminue très lentement. Si l’on répète l’expérience pour d’autres températures, on obtient le réseau d’isothermes ci-dessous. Au delà de la température critique, la liquéfaction n’est plus possible (31°C pour
.
La courbe (S) est appelée courbe de saturation, elle représente l’état du liquide pur (à gauche du point critique C) et de la vapeur saturée pure (à droite du point C). Les points situés en dessous de la courbe correspondent à un mélange de liquide et de vapeur en équilibre.
6.2.2 Courbe de pression de vapeur
Pour un équilibre liquide-vapeur, la pression et la température sont liées par une fonction
; c’est un système mono-variant (c’est à dire à un seul degré de liberté).
La courbe de pression de vapeur est limitée par le point critique C et le point triple T, point de coexistence des trois phases (vapeur, liquide, solide). La pente de la courbe n’est pas infinie en C, et différentes formules peuvent représenter cette courbe:
- formule de Rankine:
- formule de Duperray, pour l’eau entre 100 et 200 °C:
, avec
en bars et
en °C.
6.2.3 Chaleur latente de vaporisation
C’est la variation d’enthalpie d’une masse unitaire de liquide saturant qui se vaporise totalement à pression constante, et température constante évidemment.
C’est la quantité de chaleur qu’il faut fournir, à pression constante, pour vaporiser le liquide,
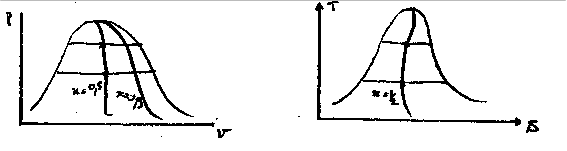
dépend de la température. Les mesures effectuées donnent une courbe de la forme ci-contre, exemple pour l’eau,
tend vers 0 pour la température critique.
Ex: pour l’eau à 100 °C:
=539 kcal/kg.
6.2.4 Formule de Clapeyron
La formule qui suit peut être démontrée à partir des deux principes. Elle n’est pas une formule approchée mais une formule thermodynamiquement exacte. Elle relie la chaleur latente à la pente de la courbe de saturation. De plus des formules analogues existent n’importe quel équilibre entre phases d’un corps pur. (par exemple l’équilibre liquide solide)
avec
et
volume massique de la vapeur et du liquide saturant.
6.2.5 Titre de vapeur
C’est le pourcentage de vapeur contenu dans un mélange liquide-vapeur à l’équilibre. On note
la masse de vapeur et
la masse de liquide. Le titre de vapeur s’écrira donc:
Les points L, M et V donnés sur la figure 6.5↑ représentent respectivement:
L Liquide saturé
V Vapeur saturée
M Mélange liquide-vapeur
On démontre aisément:
En effet, on écrira par exemple pour l’enthalpie massique du mélange:
où
est la masse totale. On procèdera de même pour les autres grandeurs extensives.
L’interprêtation graphique est donnée par le rapport de deux segments:
Ces formules permettent de tracer les lignes isotitres en divisant les paliers de vaporisation dans un rapport constant égal à
comme n peut le voir sur la figure 6.6↓
6.3 Les diagrammes thermodynamiques et leur utilisation
Il est possible de calculer les valeurs des différentes grandeurs d’état (énergie interne, enthalpie, entropie .... ) en fonction des variables d’état (P, v ou T) à l’aide d’équations d’état très développées et de diverses données expérimentales. Le développement de ces équations ainsi que leur utilisation pour les calculs est une affaire de spécialistes étant donné la lourdeur des calculs mis en jeu. Toutefois, le résultat de ce type de calculs peut être utilisé dans la pratique sous différentes formes. Certaines données peuvent être présentées sous forme de tables numériques ou sous forme graphique. La précision de ce genre de données est généralement de l’ordre de 1% ce qui est suffisant pour la plupart des calculs techniques.
A cela, viennent s’ajouter depuis quelque temps, des outils informatiques permettant de réaliser très rapidement des études de projets puisque les calculs fastidieux seront directement traités par l’ordinateur.
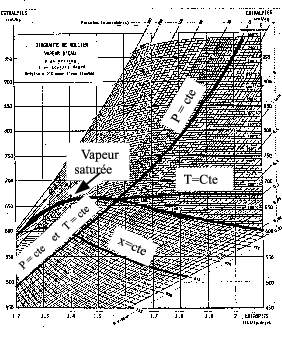
Diagramme entropique (T,s)
Ce diagramme (figure 6.7↑) a pour abscisse l’entropie massique s et pour ordonnée la température. Il est utilisé principalement pour l’étude des cycles de machines à vapeur de même que le diagramme de Mollier (voir ci-dessous)
La courbe de saturation prend une forme similaire à celle qui a été vue sur le diagramme de Clapeyron avec une courbe d’ébullition à gauche (liquide saturé) et une courbe de rosée à droite (vapeur saturée) qui se rejoignent en un point critique au sommet. Ici encore, (pour une température inférieure à la température critique), les points situés à droite de la courbe représentent les états liquides (liquide sous refroidi), les états vapeur étant représentés par les points situés à droite de la courbe de rosée. Les points situés en dessous de la courbe de saturation représentent un mélange de liquide et de vapeur à l’équilibre thermodynamique. Un segment horizontal joignant la courbe d’ébullition à la courbe de rosée est à la fois une isotherme et une isobare. La position d’un point sur cette droite dépend des proportions du mélange (titre de vapeur). En parcourant ce segment de la gauche vers la droite, on passe progressivement d’un titre de vapeur nul (liquide saturé pur) à un titre de vapeur égal à 1 (vapeur saturée seule). On trace généralement dans cette partie du diagramme les lignes isotitres. On trouve aussi souvent les isobares et isochores dans la partie correspondant à la vapeur.
On peut ainsi facilement suivre les évolutions d’un fluide et connaître la valeur de toutes les grandeurs dans chaque état. Un des intérêts de ce type de diagramme est qu’on peut facilement calculer une adiabatique réversible puisque son entropie étant constante, elle sera représentée par un segment de droite verticale.
Diagramme de Mollier (h, s)
Les coordonnées de ce diagramme sont l’entropie massique pour l’abscisse et l’enthalpie massique pour l’ordonnée. On le préfère généralement au diagramme entropique pour les calculs sur les cycles de machines à vapeur car il permet de lire directement la valeur de l’enthalpie sur l’axe des ordonnées. Or c’est celle-ci qui est nécessaire dans le cas des machines où le fluide est en écoulement (voir chap 5). On voit ici aussi une courbe de saturation mais contrairement au cas précédent, le point critique n’est pas situé au sommet de la courbe. Sur la figure ci-contre, seule la courbe de rosée est apparente. Le point critique ainsi que la courbe d’ébullition se situeraient à gauche en dehors du graphique. La raison pour laquelle le liquide n’est pas représenté est que c’est surtout la vapeur qui nous intéresse ici. Dans les installations à vapeur, le liquide est souvent proche de la saturation et des simples tables de saturation suffiront. La région au dessus de la courbe représente l’état de vapeur surchauffée et dans cette région on trace généralement les isothermes et les isobares.
Les points situés sous la courbe représentent les mélanges liquide vapeur. Les paliers de liquéfaction sont ici des droites obliques dont la pente est égale à la température absolue. En effet, la pente est égale à
. On trace aussi habituellement les courbes isotitres .
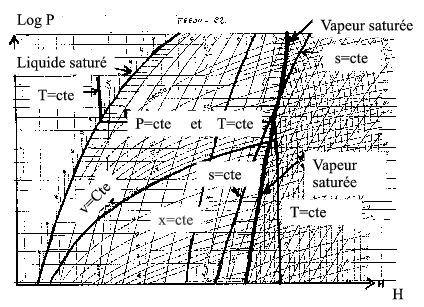
Le diagramme enthalpique (P, h)
Ce diagramme est principalement utilisé par les frigoristes pour les machines frigorifiques ainsi que les pompes à chaleur.
L’abscisse est ici l’enthalpie massique tandis que l’ordonnée est la pression souvent représentée sur une échelle logarithmique. Ici encore, on observe une courbe de saturation, liquide à gauche et vapeur à droite avec un point critique au sommet. (En général, le point critique est en dehors du dessin car la zone de travail se situe généralement au dessous). Les paliers de changement d’état (isobares et isothermes à la fois ) sont de nouveau des horizontales.
De la même manière que précédemment, on trace:
- Dans la région correspondant à la phase vapeur (à droite), les isothermes ainsi que les isentropes ou courbes isentropiques c’est à dire les courbes pour lesquelles l’entropie reste constante.
- Dans la région correspondant aux mélanges liquide-vapeur, les lignes isotitres.
- Dans la région correspondant au liquide, les isobares ne sont pas tracées compte tenu du fait qu’on sait qu’elles sont pratiquement verticales. (Du fait de l’incompressibilité du liquide, l’enthalpie est très peu sensible à la pression)
6.3.1 Les tables de vapeur
La précision de la lecture sur les diagrammes est souvent insuffisante et on a souvent recours à des tables dans lesquelles on peut trouver les valeurs des différentes grandeurs en fonction des pressions et des températures.
Il existe deux types de tables. Les tables de saturation donnent les valeurs correspondant au liquide saturé et à la vapeur saturée. Dans ce cas seule la donnée de la pression ou de la température suffit à déterminer l’état du système.On aura donc un tableau à simple entrée (température ou pression). En revanche, pour la vapeur surchauffée, il est nécessaire de donner la pression et la température pour définir l’état du système. On aura donc un tableau à double entrée.
Tables de saturation
Elles donnent généralement sur une ligne toutes les grandeurs correspondant au liquide saturé et à la vapeur saturée pour une même température (ou pression). On trouve généralement le volume massique (et quelquefois la masse volumique), l’enthalpie massique et l’entropie pour chacune des deux phases. La chaleur latente de vaporisation est donnée dans certains cas mais c’est peu utile car elle est facilement calculée comme la différence d’enthalpie entre la vapeur et le liquide. Dans certains cas, on donne deux tableaux séparés, un pour le liquide et l’autre pour la vapeur. D’autres grandeurs physiques telles que la tension superficielle ou la vitesse du son dans le fluide peuvent figurer dans certaines tables mais nous n’en ferons pas usage ici.
Attention, Les valeurs figurant dans deux tables différentes peuvent ne pas coïncider car pour des grandeurs telles que l’enthalpie et l’entropie, il est nécessaire de fixer un point de référence. Seules les variations d’enthalpie et d’entropie sont significatives. En pratique, il faut faire les calculs en utilisant la même table ou vérifier que les points de référence sont les mêmes si on utilise deux tables différentes.
Tables de la vapeur surchauffée.
Elles se présentent généralement sous la forme d’un tableau à double entrée. Dans le cas des tables de la vapeur d’eau qui vous ont été distribuées, à l’intersection entre la ligne correspondant à la pression et à la colonne correspondant à la température, on trouve une case dans laquelle sont indiquées les valeurs du volume massique, de l’enthalpie massique et de l’entropie massique pour l’état considéré. Bien entendu, pour une pression donnée, ne figurent que des températures supérieures à la température de saturation (qui dépend de la pression) car pour des températures inférieures, le fluide n’est pas une vapeur.
On trouve aussi quelquefois des données représentées sous la forme d’isothermes. On a alors un tableau pour chaque valeur de la température, chaque ligne du tableau correspondant à une pression.
Ou trouver des données thermodynamiques :
En dehors des documents que je vous distribuerai, vous pouvez trouver un grand nombre de données pour une très grande variété de molécules sur le site internet WEBBOOK à l’adresse: http://webbook.nist.gov/chemistry/ Ce site est réalisé par le NIST (National Institute of Standards and Technology). Il faut pratiquer un peu l’anglais pour l’utiliser. Je ne connais pas d’équivalent en Français. (Depuis quelques temps, l’interface est traduite en français mais certaines parties du site restent en anglais). Pour certaines substances, vous pourrez aussi utiliser les données présentes dans les logiciels que j’ai mis à votre disposition tels que Cyclepad ou Thermoptim. Solkane est spécialisé dans les fluides frigorigènes (applications frigorifiques).