IUT de St Denis
Génie Industriel et Maintenance
THERMODYNAMIQUE
(suite)

année 2002-2003
Il est possible de calculer les valeurs des différentes grandeurs d'état (energie interne, enthalpie, entropie .... ) en fonction des variables d'état (P,v ou T) à l'aide d'équations d'état très développées et de diverses données expérimentales. Le développement de ces équations ainsi que leur utilisation pour les calculs est une affaire de spécialistes étant donné la lourdeur des calculs mis en jeu. Toutefois, le résultat de ce type de calculs peut être utilisé dans la pratique sous différentes formes. Certaines données peuvent être présentées sous forme de tables numériques ou sous forme graphique. La précision de ce genre de données est généralement de l'ordre de 1% ce qui est suffisant pour la plupart des calculs techniques.
A cela, viennent s'ajouter depuis quelque temps, des outils informatiques permettant de réaliser très rapidement des études de projets puisque les calculs fastidieux seront directement traîtés par l'ordinateur.
 Ce
diagramme a pour abscisse l'entropie massique s et pour ordonnée
la température. Il est utilisé principalement pour
l'étude des cycles de machines à vapeur de même
que le diagramme de Mollier (voir ci-dessous)
Ce
diagramme a pour abscisse l'entropie massique s et pour ordonnée
la température. Il est utilisé principalement pour
l'étude des cycles de machines à vapeur de même
que le diagramme de Mollier (voir ci-dessous)
La courbe de saturation prend une forme similaire à celle qui a été vue sur le diagramme de clapeyron avec une courbe d'ébullition à gauche (liquide saturé) et une courbe de rosée à droite (vapeur saturée) qui se rejoignent en un point critique au sommet. Ici encore, (pour une température inférieure à la température critique), les points situés à droite de la courbe représentent les états liquides (liquide sous refroidi), les états vapeur étant représentés par les points situés à droite de la courbe de rosée. Les points situés en dessous de la courbe de saturation représentent un mélange de liquide et de vapeur à l'équilibre thermodynamique. Un segment horizontal joignant la courbe d'ébullition à la courbe de rosée est à la fois une isotherme et une isobare. La position d'un point sur cette droite dépend des proportions du mélange (titre de vapeur). En parcourant ce segment de la gauche vers la droite, on passe progressivement d'un titre de vapeur nul (liquide saturé pur) à un titre de vapeur égal à 1 (vapeur saturée seule). On trace généralement dans cette partie du diagramme les lignes isotitres. On trouve aussi souvent les isobares et isochores dans la partie correspondant à la vapeur.
On peut ainsi facilement suivre les évolutions d'un fluide et connaître la valeur de toutes les grandeurs dans chaque état. Un des intérets de ce type de diagramme est qu'on peut facilement calculer une adiabatique réversible puisque son entropie étant constante, elle sera représentée par un segment de droite verticale.
 Les
coordonnées de ce diagramme sont l'entropie massique pour
l'abscisse et l'enthalpie massique pour l'ordonnée. On le
préfère généralement au diagramme
entropique pour les calculs sur les cycles de machines à
vapeur car il permet de lire directement la valeur de l'enthalpie sur
l'axe des ordonnées. Or c'est celle-ci qui est nécessaire
dans le cas des machines où le fluide est en écoulement
(voir chap 5). On voit ici aussi une courbe de saturation mais
contrairement au cas précédent, le point critique n'est
pas situé au sommet de la courbe. Sur la figure ci-contre,
seule la courbe de rosée est apparente. Le point critique
ainsi que la courbe d'ébullition se situeraient à
gauche en dehors du graphique. La raison pour laquelle le liquide
n'est pas représenté est que c'est surtout la vapeur
qui nous intéresse ici. Dans les installations à
vapeur, le liquide est souvent proche de la saturation et des simples
tables de saturation suffiront. La région au dessus de la
courbe représente l'état de vapeur surchauffée
et dans cette région on trace généralement les
isothermes et les isobares.
Les
coordonnées de ce diagramme sont l'entropie massique pour
l'abscisse et l'enthalpie massique pour l'ordonnée. On le
préfère généralement au diagramme
entropique pour les calculs sur les cycles de machines à
vapeur car il permet de lire directement la valeur de l'enthalpie sur
l'axe des ordonnées. Or c'est celle-ci qui est nécessaire
dans le cas des machines où le fluide est en écoulement
(voir chap 5). On voit ici aussi une courbe de saturation mais
contrairement au cas précédent, le point critique n'est
pas situé au sommet de la courbe. Sur la figure ci-contre,
seule la courbe de rosée est apparente. Le point critique
ainsi que la courbe d'ébullition se situeraient à
gauche en dehors du graphique. La raison pour laquelle le liquide
n'est pas représenté est que c'est surtout la vapeur
qui nous intéresse ici. Dans les installations à
vapeur, le liquide est souvent proche de la saturation et des simples
tables de saturation suffiront. La région au dessus de la
courbe représente l'état de vapeur surchauffée
et dans cette région on trace généralement les
isothermes et les isobares.
Les points situés sous la courbe
représentent les mélanges liquide vapeur. Les paliers
de liquéfaction sont ici des droites obliques dont la pente
est égale à la température absolue. En effet, la
pente est égale à
![]() .
On trace aussi habituellement les courbes isotitres .
.
On trace aussi habituellement les courbes isotitres .
Ce diagramme est principalement utilisé par les frigorites pour les machines frigorifiques ainsi que les pompes à chaleur.
L'abscisse est ici l'enthalpie massique tandis que l'ordonnée est la pression souvent représentée sur une échelle logarithmique. Ici encore, on observe une courbe de saturation, liquide à gauche et vapeur à droite avec un point critique au sommet. (En général, le point critique est en dehors du dessin car la zone de travail se situe généralement au dessous ). Les paliers de changement d'état (isobares et isothermes à la fois ) sont de nouveau des horizontales.
De la même manière que précédemment, on trace:
Dans la région correspondant à la phase vapeur (à droite), les isothermes ainsi que les isentropes ou courbes isentropiques c'est à dire les courbes pour lesquelles l'entropie reste constante.
 Dans
la région correspondant aux mélanges liquide- vapeur,
les lignes isotitres.
Dans
la région correspondant aux mélanges liquide- vapeur,
les lignes isotitres.
Dans la région correspondant au liquide, les isobares ne sont pas tracées compte tenu du fait qu'on sait qu'elles sont pratiquement verticales. (Du fait de l'incompressibilité du liquide, l'enthalpie est très peu sensible à la pression)
La précision de la lecture sur les diagrammes est souvent insuffisante et on a souvent recours à des tables dans lesquelles on peut trouver les valeurs des différentes grandeurs en fonction des pressions et des températures.
Il existe deux types de tables. Les tables de saturation donnent les valeurs correspondant au liquide saturé et à la vapeur saturée. Dans ce cas seule la donnée de la pression ou de la température suffit à déterminer l'état du système.On aura donc un tableau à simple entrée (température ou pression). En revanche, pour la vapeur surchauffée, il est nécessaire de donner la pression et la température pour définir l'état du système. On aura donc un tableau à double entrée.
Elles donnent généralement sur une ligne toutes les grandeurs correspondant au liquide saturé et à la vapeur saturée pour une même température (ou pression). On trouve généralement le volume massique (et quelquefois la masse volumique), l'enthalpie massique et l'entropie pour chacune des deux phases. La chaleur latente de vaporisation est donnée dans certains cas mais c'est peu utile car elle est facilement calculée comme la différence d'enthalpie entre la vapeur et le liquide. Dans certains cas, on donne deux tableaux séparés, un pour le liquide et l'autre pour la vapeur. D'autres grandeurs physiques telles que la tension superficielle ou la vitesse du son dans le fluide peuvent figurer dans certaines tables mais nous n'en ferons pas usage ici.
Attention, Les valeurs figurant dans deux tables différentes peuvent ne pas coincider car pour des grandeurs telles que l'enthalpie et l'entropie, il est nécessaire de fixer un point de référence. Seules les variations d'enthalpie et d'entropie sont significatives. En pratique, il faut faire les calculs en utilisant la même table ou vérifier que les points de référence sont les mêmes si on utilise deux tables différentes.
Elles se présentent généralement sous la forme d'un tableau à double entrée. Dans le cas des tables de la vapeur d'eau qui vous ont été distribuées, à l'intersection entre la ligne correspondant à la pression et à la colonne correspondant à la température, on trouve une case dans laquelle sont indiquées les valeurs du volume massique, de l'enthalpie massique et de l'entropie massique pour l'état considéré. Bien entendu, pour une pression donnée, ne figurent que des températures supérieures à la température de saturation (qui dépend de la pression) car pour des températures inférieures, le fluide n'est pas une vapeur.
On trouve aussi quelquefois des données représentées sous la forme d'isothermes. On a alors un tableau pour chaque valeur de la température, chaque ligne du tableau correspondant à une pression.
En dehors des documents que je vous distribuerai, vous pouvez trouver un grand nombre de données pour une très grande variété de molécules sur le site internet WEBBOOK à l'adresse: http://webbook.nist.gov/chemistry/ Ce site est réalisé par le NIST (National Institute of Standards and Technology). Il faut pratiquer un peu l'anglais pour l'utiliser. Je ne connais pas d'équivalent en Français. Pour certaines substances, vous pourrez aussi utiliser les données présentes dans les logiciels que j'ai mis à votre disposition tels que Cyclepad ou Thermoptim. Solkane est spécialisé dans les fluides frigorigènes (applications frigorifiques).
Il ne faut pas croire que la machine à vapeur est une technologie dépassée. Certes, on ne voit plus dans nos campagnes de trains à vapeur ni sur les fleuves américains de ces bateaux à vapeur qui font le charme de certains films mais les cycles utilisant la vapeur sont encore d'actualité car une grande partie de la production d'électricité est basée sur cette technique. En effet, les centrales thermiques comme les centrales nucléaires ne sont rien d'autres que d'immenses machines à vapeur, que la chaleur soit apportée par la fission de l'uranium, ou par la combustion de charbon, de pétrole ou de gaz, le principe général de ces centrales reste le même. C'est ce principe que nous allons examiner dans ce chapitre. Un film réalisé par EDF détaillant le fonctionnement d'une centrale nucléaire vous sera projeté. On se concentrera en particulier sur le passage qui décrit le fonctionnement de la boucle secondaire qui est l'objet de notre étude.
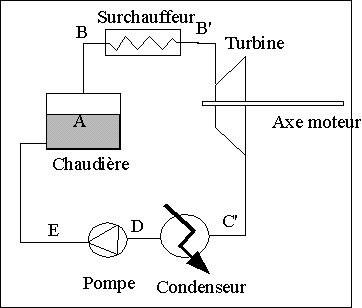
 Ces
installations sont en général constituées:
Ces
installations sont en général constituées:
D'une chaudière permettant de produire de la vapeur à haute température et à haute pression
D'une turbine où la vapeur vient se détendre en cédant une partie de son énergie sous forme de travail. Le travail ainsi récupéré sur un arbre moteur est transmis aux alternateurs de manière à le convertir en énergie électrique.
 D'un
condenseur où la vapeur est ramenée à l'état
liquide à basse pression et basse température. A
l'origine, les premières machines à vapeur ne
possédaient pas de condenseur et la vapeur détendue
était rejetée directement dans l'atmosphère ce
qui donnait ces jolis panaches de fumées blanches. L'idée
du condenseur est due à Rankine qui donnera son nom au cycle
thermodynamique décrit plus bas. L'intérêt du
condenseur est de permettre une détente jusqu'à une
pression inférieure à la pression atmosphérique
ce qui augmente le travail récupéré
D'un
condenseur où la vapeur est ramenée à l'état
liquide à basse pression et basse température. A
l'origine, les premières machines à vapeur ne
possédaient pas de condenseur et la vapeur détendue
était rejetée directement dans l'atmosphère ce
qui donnait ces jolis panaches de fumées blanches. L'idée
du condenseur est due à Rankine qui donnera son nom au cycle
thermodynamique décrit plus bas. L'intérêt du
condenseur est de permettre une détente jusqu'à une
pression inférieure à la pression atmosphérique
ce qui augmente le travail récupéré
D'une pompe refoulant le liquide condensé dans la chaudière pour que le cycle puisse recommencer.
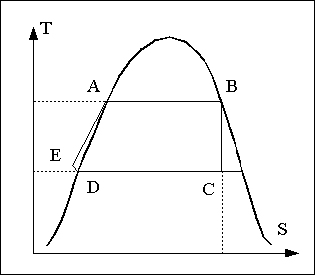
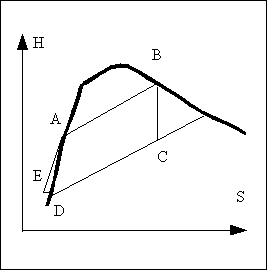
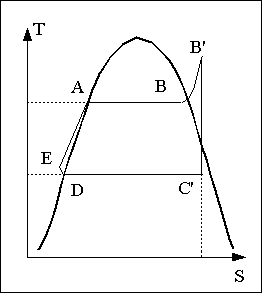
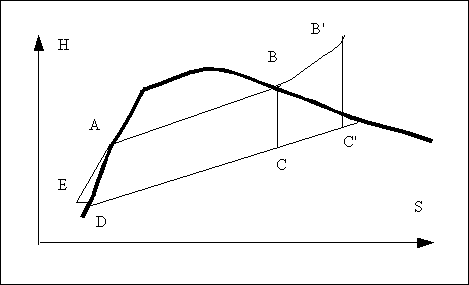
L'eau circulant dans l'installation va décrire le cycle ABCDE représenté sur la figure ci contre.
Le point D et le point E sont très proches sur le diagramme car la pompe ne fait qu'augmenter la pression en fournissant un travail négligeable par rapport aux autres échanges d'énergie en jeu. En pratique, on ne considère que le cycle ABCD nommé cycle de Rankine.
Détaillons un peu:
point A liquide saturé, haute pression haute température. C'est l'état de l'eau juste au point où elle va être vaporisée.
AB vaporisation dans la chaudière
 Point
B: Vapeur saturée, haute pression haute température
Point
B: Vapeur saturée, haute pression haute température
BC Détente de la vapeur. On la considère généralement comme adiabatique et réversible. Si la vapeur entrante est saturée, le diagramme nous montre que la vapeur doit être partiellement liquéfiée à la sortie.
Point C vapeur détendue, ici c'est un mélange liquide vapeur contenant une grande proportion de vapeur, le tout à basse pression et à basse température.
 CD
Condensation de la vapeur. La vapeur est transformée en
liquide. Ce processus doit dégager de la chaleur. Le
condenseur est généralement un échangeur de
chaleur dans lequel un courant d'eau froide constituant un circuit
distinct vient prendre la chaleur dégagée par la
condensation pour l'évacuer dans le milieu ambiant.
CD
Condensation de la vapeur. La vapeur est transformée en
liquide. Ce processus doit dégager de la chaleur. Le
condenseur est généralement un échangeur de
chaleur dans lequel un courant d'eau froide constituant un circuit
distinct vient prendre la chaleur dégagée par la
condensation pour l'évacuer dans le milieu ambiant.
Point D liquide saturé froid à basse pression qui sera réinjecté dans la chaudière par l'intermédiaire de la pompe.
DE Passage du liquide à travers la pompe. Ce processus necessite peu d'énergie en comparaison des autres quantités d'énergie échangées. En effet, l'apport de chaleur est quasi nul dans cet appareil et l'apport de travail est trop faible (du fait de la très faible compressibilité du liquide) pour que la température varie de manière sensible. Dans la pratique, on néglige purement et simplement cette étape en assimilant le point E au point D.
point E Le liquide comprimé mais à basse température introduit dans la chaudière.
EA (ou DA) Le liquide se réchauffe dans la chaudière en passant de l'entrée jusqu'à l'endroit où il sera vaporisé soit en formant une bulle, soit en s'évaporant à la surface.
On a ici un fluide (l'eau) s'écoulant à travers les divers organes de la machine. Pour les calculs énergétiques, on aura donc recours à la forme du premier principe développée pour les écoulements stationnaires dans le chapitre 5.
Pour le passage dans la turbine, c'est à dire pour l'évolution BC, on a:
![]()
La détente dans la turbine sera supposée adiabatique et réversible (donc isentropique) et la variation d'énergie cinétique est négligée. Il reste donc:
![]()
Remarquons que ce travail massique utile est négatif, ce qui est bien conforme à ce qui est attendu puisqu'il sagit d'un travail perdu pour la vapeur et donc gagné par le milieu extérieur c'est à dire ici l'alternateur.
La puisance sera alors donnée
par
![]() où
où
![]() est
le débit de vapeur traversant la machine.
est
le débit de vapeur traversant la machine.
De la même manière que précédemment, on écrit
![]()
Cette fois ci, c'est le travail utile qui est nul dans la chaudière. De même, la variation d'énergie cinétique est négligeable et il reste:
![]()
La puissance calorifique reçue par l'eau dans la chaudière est alors:
![]()
Pour une comparer une détente
adiabatique réelle (non réversible) à une
détente idéale (réversible donc isentropique),
prise comme référence, on définit le rendement
par rapport à l'isentropique, comme le rapport![]() où
où
![]() est
le travail récupéré au cours de la détente
réelle et
est
le travail récupéré au cours de la détente
réelle et
![]() est
le travail qu'aurait produit une détente isentropique avec les
mêmes conditions de départ et la même pression
finale. Par définition ce rendement est forcément
inférieur à 1 car c'est l'isentrope qui donne le
travail maximal pour une pression finale donnée. Ceci peut
être montré facilement. (voir exercices).
est
le travail qu'aurait produit une détente isentropique avec les
mêmes conditions de départ et la même pression
finale. Par définition ce rendement est forcément
inférieur à 1 car c'est l'isentrope qui donne le
travail maximal pour une pression finale donnée. Ceci peut
être montré facilement. (voir exercices).
Le terme de rendement est assez mal choisi et peut prêter à confusion car il ne s'agit pas ici d'une conversion d'énergie mais c'est le terme consacré et nous nous conformerons à l'usage.
La vapeur sortant de la chaudière étant saturée, on trouvera à la sortie de la turbine un mélange liquide-vapeur comme on peut le voir sur le diagramme. Une partie de la vapeur se condense au cours de la détente. Les gouttelettes de liquide formées sont fortement accélérées à l'intérieur de la turbine, ce qui a tendance à détériorer les pales de la turbine et à limiter le temps de fonctionnement de ces appareils.
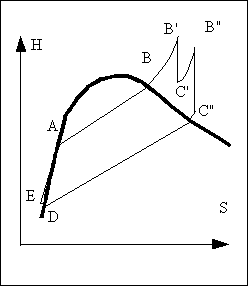
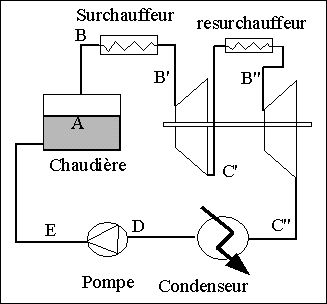
Si l'on veut remédier à ce problème, on doit faire en sorte que le fluide sortant de la turbine soit de la vapeur surchauffée. La solution consiste à séparer la vapeur du liquide en sortie de chaudière et à la surchauffer. On intercale entre la sortie de la chaudière et l'entrée de la turbine un surchauffeur dans lequel la vapeur n'étant plus en contact avec le liquide peut être chauffée jusqu'à une température plus élevée alors que la pression restera sensiblement constante.
On
peut ainsi, limiter voire supprimer, si l'on mène la
surchauffe assez loin, la condensation dans la turbine.
Un
autre avantage de la surchauffe est que le travail récupéré
dans la turbine sera plus important ce qui dans certains cas peut
améliorer le rendement. En effet, on voit bien sur le
diagramme que la variation d'enthalpie dans la turbine est plus
importante avec une surchauffe pour une même baisse de
pression.
Pour le calcul du rendement, il y a
lieu de tenir compte de la chaleur reçue par la vapeur dans le
surchauffeur. La quantité de chaleur apportée par la
source chaude sera alors:![]()

Il peut être avantageux d'utiliser une turbine à deux corps. Les deux corps de turbine sont généralement couplés sur le même axe ce qui permet de récupérer toute la puissance mécanique sur un seul arbre moteur. La vapeur se détend une première fois dans le premier corps jusqu'à une pression intermédiaire. La vapeur sortant du premier corps est alors resurchauffée à cette pression intermédiaire puis est dirrigée vers le deuxième corps de turbine où elle est détendue jusqu'à la pression finale.

Les
avantages d'une telle installation, sont les suivants.
Il est plus facile de cette façon d'obtenir un point final dans la zone de vapeur surchauffée ce qui garantit la longévité de la turbine.
D'autre part, le travail récupéré est plus important, ce qui augmente la puissance récupérée pour le même débit de vapeur.
Le rendement peut être amélioré dans certains cas.
Ces avantages sont obtenus au prix d'une plus grande complexité de l'installation et d'un prix plus élevé.
Généralement, les turbines à vapeur fonctionnent avec une pression de condensation très faible ( environ 0,1 bar) ce qui permet de récupérer plus de travail. (voir plus haut: utilité du condenseur). Mais dans ce cas, la chaleur récupérée au niveau condenseur est généralement inutilisable car la température de sortie de l'eau de refroidissement est alors trop basse (inférieure à 50°C). Dans un grand nombre de cas, la chaleur de condensation est simplement rejetée dans le milieu extérieur ( voir par exemple les tours de refroidissement qui accompagnent souvent les centrales nucléaires.), ce qui représente un gâchis important du point de vue énergétique.
Dans les turbines à
contre-pression, la détente est arrêtée à
une pression supérieure (donc T supérieure) ce qui
limite la quantité de travail récupérée
(![]() )
mais alors la quantité de chaleur rejetée au condenseur
(
)
mais alors la quantité de chaleur rejetée au condenseur
(![]() )peut
être utilisée par exemple pour chauffer des locaux ou
des serres. Par exemple, si la détente est arrêtée
à 1 bar, la température de condensation est de 100°C
ce qui permet de distribuer de l'eau chaude à 90°C. Les
quantités de chaleur ainsi récupérées
peuvent être considérables.
)peut
être utilisée par exemple pour chauffer des locaux ou
des serres. Par exemple, si la détente est arrêtée
à 1 bar, la température de condensation est de 100°C
ce qui permet de distribuer de l'eau chaude à 90°C. Les
quantités de chaleur ainsi récupérées
peuvent être considérables.
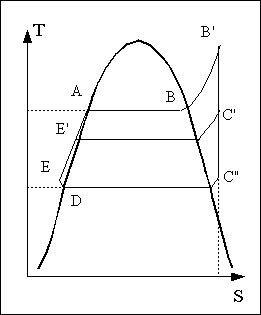

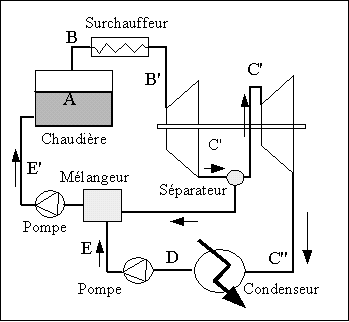
Dans
certaines installations, on réalise une détente étagée
comme ci-dessus pour le cycle à resurchauffe mais, ici une
partie du flux de vapeur issu du premier corps de turbine est dérivé
vers un mélangeur opérant à la pression
intermédiaire, mélangeur dans lequel cette vapeur
prélevée est mélangée au flux de liquide
![]() provenant
du condenseur. La vapeur se condense au contact du liquide froid
provenant du condenseur, ce qui a pour effet de préchauffer ce
liquide. Le flux de vapeur soutiré
provenant
du condenseur. La vapeur se condense au contact du liquide froid
provenant du condenseur, ce qui a pour effet de préchauffer ce
liquide. Le flux de vapeur soutiré
![]() est
calculé de telle sorte que la température finale du
liquide soit précisément la température de
saturation correspondant à la pression intermédiaire.
On obtient donc en sortie du mélangeur un liquide saturé
à la pression intermédiaire (et à la température
intermédiaire) qui est ensuite injecté dans la
chaudière. Le flux total de vapeur
est
calculé de telle sorte que la température finale du
liquide soit précisément la température de
saturation correspondant à la pression intermédiaire.
On obtient donc en sortie du mélangeur un liquide saturé
à la pression intermédiaire (et à la température
intermédiaire) qui est ensuite injecté dans la
chaudière. Le flux total de vapeur
![]() est
ainsi reconstitué. L'intérêt de ce type
d'installation ne saute pas aux yeux. Pourtant, un tel dispositif
permet d'augmenter sensiblement le rendement. En effet, grâce à
la chaleur de condensation du flux prélevé qui est
récupérée pour préchauffer l'eau sortant
du condenseur, les irreversibilités dues au chauffage de cette
eau sont réduites. L'étude d'un tel cycle est assez
complexe et sera éventuellement vue en exercice ou avec un
logiciel de simulation.
est
ainsi reconstitué. L'intérêt de ce type
d'installation ne saute pas aux yeux. Pourtant, un tel dispositif
permet d'augmenter sensiblement le rendement. En effet, grâce à
la chaleur de condensation du flux prélevé qui est
récupérée pour préchauffer l'eau sortant
du condenseur, les irreversibilités dues au chauffage de cette
eau sont réduites. L'étude d'un tel cycle est assez
complexe et sera éventuellement vue en exercice ou avec un
logiciel de simulation.
Pour maintenir un corps à basse température, il suffit de le mettre en contact avec un autre corps dont la tempéraure lui est inférieure. La chaleur allant spontanément du corps dont la température est la plus élevée vers celui dont la température est la plus basse.
Il existe plusieurs méthodes pour obtenir ce corps intermédiaire à basse température. A titre documentaire, nous en énumérons quelques unes ci- dessous. Nous nous limiterons ensuite à une étude détaillée de la machine frigorifique la plus largement employée.
La plus connue et la plus utilisée des méthodes pour faire baisser la température est la détente d'un fluide. On a vu précédemment que la détente adiabatique d'un gaz abaissait sa température. De même pour la détentes Joule-Thomson des gaz réels pourvu que la température soit inférieure au point d'inversion. De même, la détente d'un liquide saturé provoque une baisse de température puisqu'on suit alors la courbe de pression de vapeur. C'est cette dernière méthode qui est utilisée dans l'écrasante majorité des cas (voir plus bas). A noter que des machines frigorifiques à gaz ont aussi été industrialisées en particulier celles basées sur un cycle de Stirling. (On en trouve quelquefois intégrées à des caméras infrarouges pour le refroidissement du détecteur).
Une autre méthode consiste à utiliser l'effet Peltier. Il s'agit d'un phénomène irreversible couplant l'énergie électrique et l'énergie thermique. Un module à effet Peltier est une jonction entre deux matériaux (métaux, semiconducteurs) différents (tout comme un thermocouple). Lorsqu'on fait passer un courant dans cette jonction, on réalise un transfert de chaleur d'une face à l'autre du module. On peut ainsi abaisser la température d'une face du module. L'efficacité d'un tel dispositif est généralement très faible ce qui limite son champ d'application. Toutefois, un tel système pouvant être miniaturisé et contrôlé facilement, il existe des applications, notamment en électronique.
On peut citer aussi la désaimantation adiabatique qui peut permettre d'atteindre de très basses températures.
Dans la pratique, on utilise un fluide
dont on fait varier la température et la pression par
compression ou détente. Le fluide décrit un cycle entre
une source chaude de température![]() (généralement le milieu ambiant) et une source froide
de température
(généralement le milieu ambiant) et une source froide
de température
![]() (généralement
le milieu à refroidir).
(généralement
le milieu à refroidir).
Le fluide reçoit au cours du
cycle un travail
![]() et
retire la quantité de chaleur
et
retire la quantité de chaleur
![]() à
la source froide et restitue la quantité de chaleur
à
la source froide et restitue la quantité de chaleur
![]() à
la source chaude.
à
la source chaude.
Le principe de la machine est le même.
Mais la machine est regardée cette fois-ci du coté de
la source chaude. C'est ici la quantité de chaleur
![]() fournie
à la source chaude qui nous intéresse. La différence
entre machine frigorifique et pompe à chaleur est uniquement
dans l'utilisation de la machine comme illustré sur la figure.
Ici, la quantité de chaleur
fournie
à la source chaude qui nous intéresse. La différence
entre machine frigorifique et pompe à chaleur est uniquement
dans l'utilisation de la machine comme illustré sur la figure.
Ici, la quantité de chaleur
![]() est
extraite de la source froide qui est généralement le
milieu ambiant (air extérieur, eau d'un fleuve ou d'un lac) et
la quantité de chaleur
est
extraite de la source froide qui est généralement le
milieu ambiant (air extérieur, eau d'un fleuve ou d'un lac) et
la quantité de chaleur
![]() est
fournie à la source chaude qui est généralement
un bâtiment à chauffer. Tout se passe comme si on
puisait la chaleur dans la source froide pour la « monter »
vers la source chaude d'où le nom de pompe à chaleur.
est
fournie à la source chaude qui est généralement
un bâtiment à chauffer. Tout se passe comme si on
puisait la chaleur dans la source froide pour la « monter »
vers la source chaude d'où le nom de pompe à chaleur.
On appelle efficacité
frigorifique, le rapport
![]() de
la chaleur retirée de la source froide au travail reçu
par le fluide au cours du cycle. Ce paramètre constitue bien
une mesure de l'efficacité de la machine puisque la quantité
de chaleur
de
la chaleur retirée de la source froide au travail reçu
par le fluide au cours du cycle. Ce paramètre constitue bien
une mesure de l'efficacité de la machine puisque la quantité
de chaleur
![]() est
bien l'effet frigorifique recherché tandis que le travail est
le « prix à payer » énergétiquement
pour obtenir ce résultat.
est
bien l'effet frigorifique recherché tandis que le travail est
le « prix à payer » énergétiquement
pour obtenir ce résultat.
Le COP est défini comme le
rapport de la quantité de chaleur rejetée vers la
source chaude au travail reçu par le fluide au cours du cycle
soit:
![]() .
Ici, c'est l'apport de chaleur à la source chaude qui est
l'effet recherché.
.
Ici, c'est l'apport de chaleur à la source chaude qui est
l'effet recherché.
Contrairement au rendement défini précédemment pour les moteurs, l'efficacité et le COP peuvent être supérieurs à 1 car ils ne concernent pas une transformation d'énergie mais un déplacement d'énergie de la source froide vers la source chaude.
 Le
cycle de Carnot a un intérêt surtout théorique.
Il représente la machine la plus efficace fonctionnant entre
deux sources de températures fixées. (Théorème
de Carnot)
Le
cycle de Carnot a un intérêt surtout théorique.
Il représente la machine la plus efficace fonctionnant entre
deux sources de températures fixées. (Théorème
de Carnot)
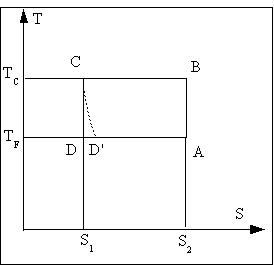
Le cycle de Carnot est constitué de 2 isothermes réversibles (échanges de chaleur avec les souces) et de deux adiabatiques réversibles (une compression pour augmenter la température, une détente pour baisser la tempéraure au niveau de la température de la source froide). Le cycle est tracé sur la figure sur un diagramme entropique. Il apparaît sur ce diagramme comme un rectangle puisque soit la température, soit l'entropie est constante).
Il est facile de calculer l'efficacité et le COP d'un tel cycle:
![]() et
et
![]()
Exercice: Le démontrer
On peut remarquer que l'efficacité et le COP sont d'autant plus élévés que les températures des sources sont proches. A la limite, ils deviennent infinis si les températures des sources sont identiques, mais dans ce cas, l'intérêt de la machine devient nul. A l'inverse, si les températures des sources sont trop distantes l'efficacité frigorifique et le COP sont faibles. Dans la pratique, on n'utilise une pompe à chaleur qu'à la mi-saison, lorsque les températures extérieures ne sont pas trop basses. Dans les années 80-90, le système PERCHE (Pompe à Chaleur en Relève de Chaudière Existante) promu par EDF en vue d'économies d'énergie, associait à une pompe à chaleur, une chaudière au Fuel qui démarrait automatiquement par grand froid c'est à dire lorsque la pompe à chaleur devenait moins performante. De même si l'on désire descendre à de très basses températures on procèdera par étapes et on utilisera un cycle à compression étagée. (voir plus bas).
On peut aussi remarquer que si l'on cherche à atteindre de très basses températures, l'efficacité frigorifique baisse considérablement et tend même vers zéro si l'on cherche à atteindre le zéro absolu. Il est donc impossible de refroidir un corps jusqu'à la température du zéro absolu par un tel procédé. Certains y voient une preuve de l'impossibilité d'atteindre le zéro absolu.
Le cycle de Carnot n'est pas utilisé dans la pratique pour les machines frigorifiques comme pour les moteurs et pour les mêmes raisons. Il est difficile de récupérer le travail de détente. Cela mettrait en jeu une mécanique trop compliquée. On lui préfèrera le cycle de Rankine inversé et ses dérivés décrits ci-après. Ces cycles sont des cycles à changement de phase où la détente isentropique du cycle de Carnot est remplacée par une détente par laminage du fluide. Une telle détente très iréversible, est représentée en pointillés sur le diagramme. Au point D' en fin de détente l'entropie est supérieure à celle du point D car la détente est adiabatique mais irréversible.
C'est un cycle à changement de phase. Comme pour les cycles des turbines à vapeur, ce type de cycle présente l'avantage d'utiliser la chaleur latente de vaporisation ce qui permet des grandes quantités de chaleurs échangées par unité de masse de fluide. Il en résulte des machines moins volumineuses et des débits de fluide moindres.
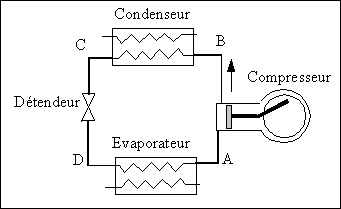
Constitution de la machine.
Précisons un peu. Le fluide dont nous parlons (que nous appellerons fluide frigorigène) circule en circuit fermé dans une boucle constituée des éléments suivants:
Un compresseur, Un échangeur de chaleur en contact avec la source chaude dénommé condenseur. Un détendeur qui est le plus souvent une vanne à pointeau ou un petit tube capillaire, Un autre échangeur de chaleur en contact avec la source froide dénommé évaporateur.
Dans ce qui suit, on décrit l'évolution du fluide dans les différents organes de la machine en précisant à chaque étape l'état du fluide entre deux transformations. Le cycle correspondant sera tracé sur le diagramme logP-h.
On commencera pour fixer les idées à la sortie de l'évaporateur. Le fluide est alors à l 'état de vapeur.
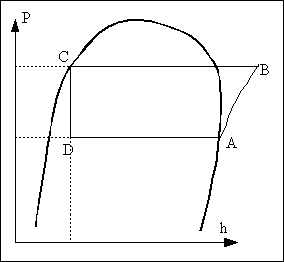
Etat A: on est en présence de vapeur de fluide frigorigène sous basse pression et à basse température et généralement assez proche de la saturation..
AB: Compression de la vapeur dans le compresseur. La compression est généralement considérée comme adiabatique et réversible. Sur le diagramme on suivra donc une ligne isentrope (entropie constante).
Etat B: La vapeur ayant été comprimée, elle est maintenant à une pression élevée mais sa température a aussi augmenté ce qui ne devrait pas nous étonner étant donné ce qu'on sait des compressions adiabatiques des gaz. De plus, un coup d'oeil sur le diagramme nous permet de voir que cette vapeur est surchauffée.
BC. La vapeur entre dans le condenseur où elle cèdera sa chaleur à la source chaude. Cet échange de chaleur a pour effet dans un premier temps de baisser la température du fluide de manière isobare mais dès que la température de saturation est atteinte, le fluide commence à se condenser. A la sortie du condenseur, on récupère donc un liquide.
Etat C: Le fluide est généralement à l'état de liquide saturé sous haute pression et à la température de saturation correspondante.
CD: La pression du fluide baisse au passage par le détendeur de même que la température. La détente est généralement considérée comme isenthalpique (enthalpie constante) pour des raisons qui seront précisées ci- dessous:
Aucun travail utile n'est échangé
lors de cette évolution. Les échanges de chaleur de
même que la variation d'énergie cinétique sont
négligeables. L'application du premier principe à cet
écoulement se réduit alors à
![]() .
Il s'agit ici d'une détente très irréversible
du fait de l'action des forces de frottement qui absorbent de
l'énergie et s'opposent à l'augmentation de l'énergie
cinétique. On a ici une situation similaire à celle
décrite pour la détente Joule-Thomson pour les
gaz.(voir chapitre 3).
.
Il s'agit ici d'une détente très irréversible
du fait de l'action des forces de frottement qui absorbent de
l'énergie et s'opposent à l'augmentation de l'énergie
cinétique. On a ici une situation similaire à celle
décrite pour la détente Joule-Thomson pour les
gaz.(voir chapitre 3).
Etat D: En examinant le diagramme, on voit que le résultat de la détente donne un point dans la zone liquide-vapeur. Le liquide s'est donc partiellement vaporisé. Toutefois, la fraction de vapeur est assez faible et le mélange est majoritairement liquide.
DA: Le mélange est entièrement vaporisé au passage à travers l'évaporateur sous l'effet de la chaleur qu'il reçoit de la source froide. En effet la détente abaisse suffisamment la température du fluide pour que celle-ci soit inférieure à celle de la source froide. La chaleur passe donc spontanément vers le fluide dont la température est plus basse. C'est dans l'évaporateur que l'effet frigorifique recherché est obtenu.
Etat A. Le fluide est entièrement vaporisé et le cycle peut recommencer.
Pour les calculs énergétiques on procèdera de la même manière que pour les cycles à vapeur du chapitre précédent et on appliquera le premier principe à l'écoulement de fluide à travers chacun des organes.
Par exemple, le travail utile fourni
par le compresseur sera donné par:![]() ce qui donne, puisque la variation d'énergie cinétique
et la quantité de chaleur échangée sont
négligeables:
ce qui donne, puisque la variation d'énergie cinétique
et la quantité de chaleur échangée sont
négligeables:
![]() ou encore la puissance utile:
ou encore la puissance utile:
![]() où
où
![]() est
le débit massique de fluide frigorigène.
est
le débit massique de fluide frigorigène.
De même pour l'évaporateur,
la quantité de chaleur retirée à la source
froide se réduira à
![]() puisqu'ici
c'est le travail utile qui est nul car aucune pièce mécanique
n'est mise en mouvement dans l'évaporateur et ses parois sont
fixes. La puissance frigorifique sera obtenue de même en
multipliant cette quantité de chaleur par le débit
massique.
puisqu'ici
c'est le travail utile qui est nul car aucune pièce mécanique
n'est mise en mouvement dans l'évaporateur et ses parois sont
fixes. La puissance frigorifique sera obtenue de même en
multipliant cette quantité de chaleur par le débit
massique.
Afin de comparer la machine réelle
à la machine idéalisée par le cycle décrit
plus haut, on introduit quelquefois un rendement par raport à
l'isentropique comme dans le cas des turbines. Il est défini
comme:![]() où
où
![]() est
le travail réel et
est
le travail réel et
![]() le
travail pour l'évolution isentropique ayant le même
point de départ et ayant la même pression finale. Ce qui
donnerait :
le
travail pour l'évolution isentropique ayant le même
point de départ et ayant la même pression finale. Ce qui
donnerait :![]() .
On a supposé ici que les deux évolutions étaient
adiabatiques, l'évolution réelle étant
irréversible. Le point B' représentant l'état
final pour la transformation réelle et le point B celuide la
transformation isentropique.La quantité
.
On a supposé ici que les deux évolutions étaient
adiabatiques, l'évolution réelle étant
irréversible. Le point B' représentant l'état
final pour la transformation réelle et le point B celuide la
transformation isentropique.La quantité
![]() est
forcément inférieure à 1. Le même genre de
remarques que pour le rendement des turbines s'applique ici. Voir
chapitre précédent.
est
forcément inférieure à 1. Le même genre de
remarques que pour le rendement des turbines s'applique ici. Voir
chapitre précédent.
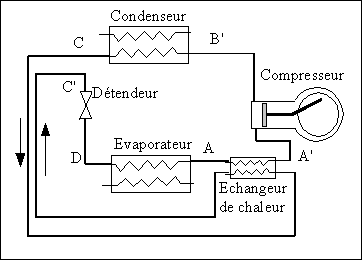
 On
peut améliorer l'efficacité frigorifique du cycle et
augmenter la puissance frigorifique en sous refroidissant le liquide
sortant du condenseur. Le point représentatif du fluide à
l'entrée du détendeur (point C') est décalé
dans la zone du liquide sous refroidi, ce qui a pour conséquence
comme on le voit sur le diagramme que le point représentant le
fluide en sortie du détendeur est plus proche de l'état
de liquide saturé. Il en résulte que la quantité
de chaleur nécessaire à la vaporisation est alors plus
grande. D'où une puissance frigorifique plus grande.
On
peut améliorer l'efficacité frigorifique du cycle et
augmenter la puissance frigorifique en sous refroidissant le liquide
sortant du condenseur. Le point représentatif du fluide à
l'entrée du détendeur (point C') est décalé
dans la zone du liquide sous refroidi, ce qui a pour conséquence
comme on le voit sur le diagramme que le point représentant le
fluide en sortie du détendeur est plus proche de l'état
de liquide saturé. Il en résulte que la quantité
de chaleur nécessaire à la vaporisation est alors plus
grande. D'où une puissance frigorifique plus grande.
Un moyen d'obtenir ce résultat
consiste à insérer dans le circuit, un échangeur
de chaleur, comme indiqué sur la figure. Par ce biais, le
liquide (chaud ) sortant du condenseur est mis en contact thermique
avec la vapeur froide issue de l'évaporateur. Ainsi, le
liquide se sous refroidit tandis que la vapeur se surchauffe dans ce
petit échangeur. Dans ces conditions, la quantité de
chaleur retirée à la source froide (effet frigorifique)
devient:
![]() plutôt que
plutôt que
![]() tandis que le travail de compression
tandis que le travail de compression
![]() reste
sensiblement le même comme on le voit sur le diagramme. Il en
résulte une augmentation de l'efficacité frigorifique.
De même, le COP de la machine vue comme une pompe à
chaleur est augmenté car la quantité de chaleur cédée
à la source chaude devient
reste
sensiblement le même comme on le voit sur le diagramme. Il en
résulte une augmentation de l'efficacité frigorifique.
De même, le COP de la machine vue comme une pompe à
chaleur est augmenté car la quantité de chaleur cédée
à la source chaude devient
![]() plutôt que
plutôt que
![]()
Il existe d'autres améliorations, notamment des cycles avec compressions étagées et soutirages similaires aux améliorations signalées pour les cycles à turbines. On étudiera ces améliorations au travers d'exercices et de travail dirrigé avec les logiciels.