Chapitre 4 Deuxième principe de la thermodynamique
Deuxième principe de la thermodynamique ou principe de Carnot . Notion
d'Entropie
Le deuxième principe permet de déterminer le sens des transformations
naturelles.
Le premier principe de la thermodynamique exprime l'existence d'une
grandeur, l'énergie interne, qui reste constante au cours de transformations
d'un système isolé: on dit que c'est un principe de conservation.
Mais si E et E' sont deux états du système, il ne permet pas de savoir
si celui-ci peut passer de E à E' ou de E' à E, dans des conditions
extérieures imposées.
Le second principe de la thermodynamique permet de répondre à cette
dernière question: on dit que c'est un principe d'évolution. Alors
que le premier principe fait jouer des rôles symétriques au travail
et à la chaleur, le second principe leur fait jouer des rôles dissymétriques.
4.1 Historique: Enoncés classiques
Les idées sur le deuxième principe ont cristallisé vers le milieu
du 19ème siècle. En effet, Sadi Carnot est mort assez jeune et ses
travaux de pionnier (1824) sont tombés dans l'oubli pendant près d'un
quart de siècle. C'est en raisonnant sur le cycle de Carnot avec ses
2 sources de chaleur de températures différentes que les physiciens
de l'époque vont établir ce que nous connaissons aujourd'hui comme
le second principe de la thermodynamique. On a coutume de distinguer
deux expressions équivalentes de ce principe:
Enoncé de Clausius (1851)
Le passage de la chaleur d'un corps froid vers un corps chaud n'a
jamais lieu spontanément ou sans compensateur dans le milieu extérieur.
Enoncé de Kelvin (1850)
Une machine décrivant un cycle et n'échangeant de la chaleur qu'avec
une seule source de chaleur ne peut pas fournir du travail.
Equivalence des deux énoncés.
Si le premier énoncé était faux, si la chaleur passait spontanément
d'un corps froid à un corps chaud, on pourrait ainsi accentuer des
écarts de température, et en particulier obtenir à partir d'une source
monotherme un ensemble de sources à températures différentes. Le deuxième
énoncé deviendrait faux également. Si le deuxième énoncé était faux,
s'il était possible de créer du travail à l'aide d'une source à température
unique (en lui enlevant de la chaleur, d'après le principe de l'équivalence),
on pourrait par le frottement, convertir ce travail en chaleur à une
température supérieure à celle de la source et ainsi on aurait, en
définitive, transporté de la chaleur d'une température inférieure
à une température supérieure sans autre modification. Le premier énoncé
serait inexact.
4.2 Enoncé moderne: Entropie
Les travaux de Clausius sur les cycles de carnot l'ont amené à définir
une fonction d'état nommée entropie que nous définirons comme suit:
Il existe une fonction d'état S telle que pour toute transformation
permettant de passer d'un état 1 à un état 2,
où δ Q est la quantité de chaleur échangée à chaque instant
avec un milieu extérieur à la température Te.
L'égalité a lieu pour toutes les transformations réversibles:
Dans ce cas, on peut utiliser la température du système car si la
transformation est réversible, on doit avoir: T≃ Te
ou encore:
Cette dernière formule permet de calculer S. L'unité S.I. pour l'entropie
se déduit aisément: J.K−1)
De plus, on peut ainsi donner une nouvelle définition de la température
qui devra coincider avec l'ancienne:
T=δ Qrev/dS est appelé température thermodynamique
du système.
Il est possible de montrer l'équivalence de cette notion de température
avec la température absolue du thermomètre à gaz parfait (K) qui
est une température thermodynamique. C'est toujours elle que nous
utiliserons. Rappelons que T est alors la température du système puisqu'il
y a réversibilité.
Conséquences:
-
Pour une transformation adiabatique, on a δ Q=0 ce qui implique:
S2−S1≥0 et si elle est réversible: S2−S1=0. on
dit alors que la transformation est isentropique.
- Evolution irréversible quelconque:
La différence entre les deux membres de cette inéquation fournit
une mesure de la réversibilité du processus ce qui conduit certains
auteurs à poser:
quantité qui doit rester toujours positive.( Δ Scree≥0
)
- Pour un système isolé, là encore: δ Q=0 soit:
S2−S1≥0
L'entropie d'un système isolé ne peut qu'augmenter. On dit qu'il
y a création d'entropie. La création d'entropie est due à des échanges
internes au système (entre différentes parties du système).
- Un peu de philosopie: On peut considérer l'univers comme un système
isolé. Son entropie ne peut donc qu'augmenter. Dès lors, ce qu'affirme
le deuxième principe, c'est que l'univers est en constante évolution
vers une plus grande entropie. L'idée très longtemps admise d'un univers
statique (ou cyclique)où tout est un éternel recommencement est ainsi
battue en brèche. Le deuxième principe est un des arguments forts
en faveur de la théorie dite du “Big Bang”.
4.3 Cycles
4.3.1 Cycles monothermes
Un cycle monotherme ne peut pas produire de travail (énoncé de Kelvin).
Si le système produit du travail, on doit avoir, selon nos conventions
de signe: W<0.
Or, si le système décrit un cycle monotherme, ceci est impossible.
En effet, pour un cycle Δ S=0 donc ∫δ Q/Te≤0
donc ici Q≤0 car T est positif et il n'y a ici qu'une seule
source de chaleur. Le premier principe exige alors que W soit positif
car pour un cycle,
Δ U=0 soit ici W=−Q≥0 .
Remarque: Dans le cas d'un cycle réversible monotherme, la seule solution
est W=0 et Q=0, ce qui correspond à une machine de peu d'intérêt.
4.3.2 Cycles dithermes
Pour qu'une machine cyclique ditherme fournisse du travail, il faut
qu'elle reçoive de la chaleur de la source chaude et qu'elle en restitue
une partie à la source froide.
Une machine thermique ditherme emprunte nécessairement de la chaleur
à la source chaude et restitue une quantité de chaleur plus petite
à la source froide. C'est la différence qui apparait sous forme de
travail.
Ce que nous venons de dire peut être envisagé comme une conséquence
du deuxième principe. En effet, considérons une machine cyclique ditherme
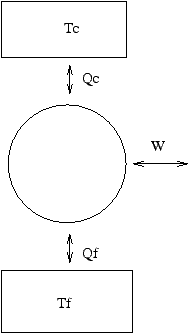
fonctionnant entre 2 sources de chaleur Σc (source chaude)
et Σf (source froide) dont les températures seront respectivement
Tc et Tf.. Au cours du cycle, la machine (ou plutôt l'agent
thermique qu'elle contient) va échanger la quantité de chaleur Qc
avec la source chaude etQf avec la source froide. De plus, le
travail échangé par notre système avec le milieu extérieur sera noté
W.
Machine motrice:
Pour que la machine soit un moteur, c'est à dire qu'elle produise
du travail, il faut que W soit négatif. Voyons dans quelles condition
cela est possible au regard du deuxième principe:
D'après le premier principe, s'agissant d'une machine cyclique Q
doit être positif. on a donc:
Qc+Qf≥0
Par ailleurs, l'application du second principe se traduit ici par
l'inégalité suivante appelée inégalité de Clausius:
.
Remarque:
Historiquement, c'est cette inégalité qui a conduit Clausius à définir
la notion d'Entropie en généralisant à une infinité de sources.
Pour obtenir:
Qc+Qf≥0
il y a trois cas possibles:
-
Qc≥0 et Qf≥0. Or ceci est impossible car d'après l'inégalité
de Clausius, l'une au moins des 2 quantités de chaleur devrait être
négative car les température sont elles aussi bien entendu positives.
- Qc≤0 et Qf≥0 avec |Qf|≥|Qc|
c'est à dire Qf≥−Qc . Un tel cas est encore impossible
en raison de l'inégalité de Clausius qui implique
. or Tf<Tc donc Qf≤−Qc ce qui rentre en contradiction
avec l'hypothèse de départ.
- Qf≤0 et Qc≥0 avec |Qc|≥|Qf|
c'est à dire Qc≥−Qf . Ce dernier cas est le seul possible
et il correspond au fonctionnement décrit plus haut. Le système reçoit
de la chaleur de la source chaude (Qc≥0) et cède à la source
chaude une quantité de chaleur inférieure (Qf≤0 et |Qc|≥|Qf|)
la différence, à savoir
|
W=−Qc−Qf=− |
⎛
⎝ |
| |
Qc |
| |
− |
| |
Qf |
| |
⎞
⎠ |
Rendement:
Théorème de Carnot
Le rendement est défini comme le rapport du travail produit à la quantité
de chaleur prise à la source chaude. En effet, c'est cette dernière
qui doit être fournie à la machine pour la faire fonctionner tandis
que la quantité de chaleur cédée à la source froide est généralement
perdue. Celle-ci est généralement rejetée dans le milieu ambiant qui
tient lieu de source froide. En tout état de cause, cette quantité
de chaleur est considérée comme perdue car elle n'a pas été transformée
en travail.
on a donc:
ce qui donne:
soit, d'après l'inégalité de Clausius
En effet, linégalité de Clausius implique:
Théorème de Carnot: Le rendement maximal d'une machine motrice ditherme
est égal à
Ce rendement ne peut être atteint que si le cycle est réversible.
Toutes les machines thermiques cycliques réversibles fonctionnant
entre deux sources de chaleur ont le même rendement thermique: Toutes
les machines irréversibles entre ces deux sources auront un rendement
inférieur.
Cycle de Carnot d'un gaz parfait
Le cycle ditherme réversible par excellence est le cycle de Carnot
présenté ci- dessous.
Le cycle de Carnot est constitué de 2 isothermes et de 2 adiabatiques
réversibles. La réversibilité thermique est assurée du fait que le
système restant en contact avec une source de chaleur échange de la
chaleur avec elle en restant sensiblement à la même température sur
les les isothermes et aussi du fait qu'il n'y a aucun échange de chaleur
avec le milieu extérieur pendant que le système change de température.
Note: il existe d'autres cycles réversibles équivalents au cycle de
Carnot et donc ayant le même rendement. Ces cycles font appel à un
régénérateur de chaleur et doivent forcément comporter 2 isothermes
à la température des sources; sinon, l'échange de chaleur avec les
sources ne pourrait pas être réversible. Certains de ces cycles seront
étudiés en travaux dirrigés.
Cycle de Carnot d'un gaz parfait.
Le cycle de Carnot d'un gaz parfait est illustré dans la figure ci-dessous.
Il se compose de deux branches d'isothermes réversibles AB et CD et
de deux branches d'adiabatiques réversibles BC et DA.
Exercice: Montrer que le rendement d'un tel cycle est égal à